Por Jonathan Rodríguez, Rebeca Rosas, Rebeca Escutia, Ana Sandoval, Arturo Santos y Juan Armendáriz
La enfermedad de hígado graso asociado al metabolismo (MAFLD, por sus siglas en inglés; Metabolic associated fatty liver disease) ha cobrado importancia en tiempos recientes debido su alta incidencia en las sociedades occidentales. Se caracteriza por la presencia de esteatosis hepática acompañada por alguna de las siguientes tres condiciones: sobrepeso u obesidad, diabetes mellitus tipo 2 o evidencia de alguna desregulación metabólica en personas con normopeso. (1)
El origen de la enfermedad de hígado graso asociado al metabolismo es multifactorial, ya que obedece a diversas interacciones del organismo con el medio ambiente. Actualmente, los datos de países occidentales sugieren una incidencia del 20-30% en estas poblaciones. Principalmente, su presencia está asociada al elevado consumo de alimentos ricos en energía; principalmente en forma de azucares simples y grasas saturadas.(2)
Alguna vez te has preguntado si ¿El estilo de vida afecta la manera en la que nuestros genes se expresan? Pues la respuesta podría sorprenderte: la manera en la que interactuamos con nuestro ambiente es crucial para determinar los mecanismos por los cuales nuestros genes se regulan, y esos procesos implican la metilación del DNA (Ácido Desorribonucléico), la metilación y/o acetilación de histonas y la expresión de RNA Ácido Ribonucléico) no codificantes o miRNAs (del inglés micro RNAs). Mecanismos conocidos en conjunto como regulación epigenética de la expresión génica.
Las histonas son unas proteínas con alto contenido de aminoácidos de carga positiva (lisina y arginina) que se compactan con nuestro DNA para formar la cromatina. La buena noticia es que estos cambios epigenéticos ( o sea modificaciones en nuestro epigenoma) son reversibles e intercambiables a expensas de la mencionada interacción del cuerpo humano con su medio ambiente, por lo que cambios en el estilo de vida, alimentación, consumo de superalimentos, realización de actividad física o ingesta de fármacos pueden influenciar estos mecanismos que regulan la expresión de nuestros genes.(3)
Las alteraciones en la epigenética que se lleva a cabo en el órgano hepático contribuyen significativamente al desarrollo de MAFLD, al alterar el metabolismo de la glucosa y principalmente el lipídico, aportando al acúmulo de grasa en el hígado y con ello al desarrollo de un proceso inflamatorio. (4)
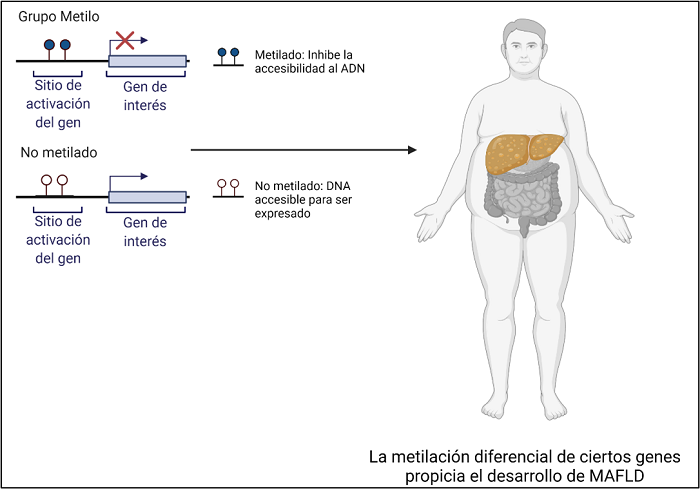
Metilación del ADN
La metilación del ADN es una de las marcas epigenéticas que pueden indicar patrones, los cuales se asocian al desarrollo de MAFLD. En la secuencia del DNA hay regiones consenso en cada gen, las cuales permiten interactuar con grupos metilo. Esta molécula está compuesta por un átomo de carbono y tres de hidrogeno (CH3) que se une al DNA y cambian la forma en la este funcionara en el organismo. Cuando se agrega una alta cantidad de grupos metilo al DNA en determinado gen, se reprime su expresión; y cuando se retiran estos grupos, el gen se encuentra disponible para interactuar con otras moléculas y poder ser expresado. (5)
Cada proceso biológico refleja la interacción de un complejo de múltiples moléculas interactuando para generar una acción dentro del organismo, por lo que, se requiera de la alteración de múltiples vías para que se desarrolle una enfermedad. En el caso de MAFLD, la desregulación metabólica está claramente asociada con el metabolismo de la glucosa y los lípidos; los patrones de metilación en los genes involucrados en estas vías se encuentran alterados. Aquellos que expresan proteínas que provocan que aumente el daño se encuentran hipometilados (aumentando su expresión) y a su vez, los que generarían efectos benéficos o contrarrestarían los efectos negativos, se mantienen hipermetilados. (6)
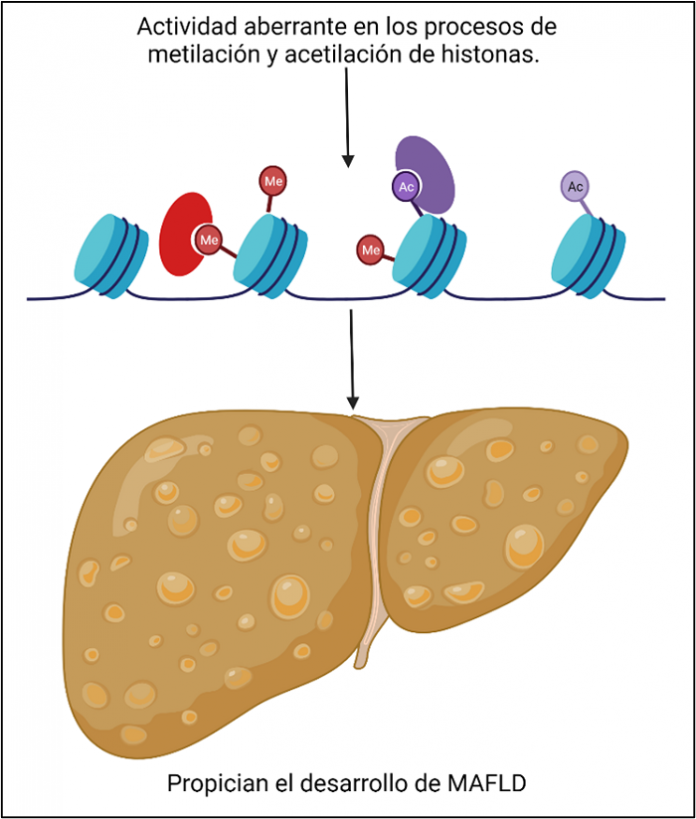
Histonas
El DNA es una molécula grande, organizada y empaquetada dentro del núcleo de las células de una manera eficaz; gracias a su unión con las proteínas histonas. El conjunto de 8 moléculas de histonas, de 4 tipos (H2a, H2b, H3 y H4), forma un complejo compacto que une al DNA a través de cargas electrostáticas y le permite reversibilidad en la unión para que pueda estar disponible según se requiera. (7)
El ADN se enrolla alrededor de este complejo de histonas y se compacta al grado de caber perfectamente dentro del núcleo, pero mientras el ADN se encuentra compactado esta inhibido. Así es como se regula la expresión de genes a nivel de histonas, pues ellas facilitan la compactación o descompactación del DNA a expensas de la adición de grupos químicos como el metilo y el acetilo respectivamente. Hay aminoácidos específicos en las histonas en los que los grupos químicos se asocian, determinando los genes que se tendrán que expresar y de los que no. (8)
Durante el desarrollo de la MAFLD, se modifica la metilación y/o acetilación de histonas; y por lo tanto su afinidad al DNA. De esta forma se altera el estado de normalidad; y genes usualmente inhibidos se encuentran disponibles y activos, propiciando el daño hepático y como consecuencia la progresión de la enfermedad. (9)
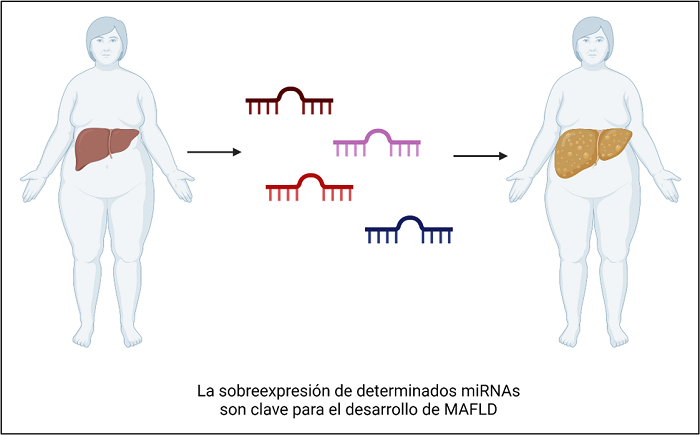
miRNAs
El RNA es el otro ácido nucleico que acarrea la secuencia copiada del DNA con información necesaria para la producción de un producto funcional. En particular el DNA mensajero es traducido a una proteína determinada y una alteración en la secuencia generaría moléculas deficientes o inservibles. Los miRNAs o microRNAs no codifican para ningún producto, sin embargo, regulan a nivel citoplasmático la expresión de las proteínas a través de la degradación o inhibición del mRNA al cual se unen mediante apareamiento de bases. En MAFLD se ha demostrado como determinados miRNAs están sobreexpresados, inactivando ciertas proteínas que ayudarían a lograr la homeostasis lipídica, por lo cual, el daño hepático continua. (10)
Conclusión
Actualmente, la MAFLD se ha posicionado como un problema de salud a nivel global, asociado muy fuertemente a la obesidad, diabetes mellitus tipo 2 y finalmente al síndrome metabólico. Se ha demostrado como las alteraciones en los mecanismos epigenéticos van de la mano con la enfermedad. La investigación de estos patrones ha permitido el conocer a fondo el padecimiento y a su vez ha abierto la posibilidad de encontrar blancos terapéuticos que aporten una posible cura.
Autores
- Rodríguez-Sanabria Jonathan Samael es estudiante del doctorado en ciencias de Biología Molecular en Medicina del CUCS, Universidad de Guadalajara
- Rosas Campos Rebeca es estudiante del doctorado en ciencias de Biología Molecular en Medicina del CUCS, Universidad de Guadalajara
- Escutia-Gutiérrez Rebeca es doctora en ciencias en Farmacología, CUCS, Universidad de Guadalajara
- Sandoval-Rodríguez, Ana Sandoval, es Profesora Titular B en el Instituto de Biología Molecular en Medicina y Terapia Génica del CUCS, Universidad de Guadalajara, es Nivel 2 en el SNI y tiene su doctorado en ciencias biomédicas por la Universidad de Guadalajara
- Santos-García, Arturo es Director de Transferencia de Tecnología / VP Investigación Tecnológico de Monterrey, Es nivel 2 en el SNI.
- Armendáriz-Borunda, Juan es Director del Instituto de Biología Molecular en Medicina y Terapia Génica del CUCS, Universidad de Guadalajara, Profesor Star en el Tecnológico de Monterrey y Nivel 3 del SNI
Referencias
- Eslam M, Newsome PN, Sarin SK, Anstee QM, Targher G, Romero-Gomez M, et al. A new definition for metabolic dysfunction-associated Fatty liver disease: an international expert consensus statement. J Hepatol. (2020) 73:202–9. doi: 10.1016/j.jhep.2020.03.039
- Nilsson EE, Sadler-Riggleman I, Skinner MK. Environmentally induced epigenetic transgenerational inheritance of disease. Environ Epigenet. (2018) 4: dvy016. doi: 10.1093/eep/dvy016
- Beekman M, Nederstigt C, Suchiman HE, Kremer D, van der Breggen R, Lakenberg N, et al. Genome-wide association study (GWAS)–identified disease risk alleles do not compromise human longevity. Proc Natl Acad Sci USA. (2010) 107:18046–9. doi: 10.1073/pnas.1003540107
- Rodríguez-Sanabria JS, Escutia-Gutiérrez R, Rosas-Campos R, Armendáriz-Borunda JS, Sandoval-Rodríguez A. An Update in Epigenetics in Metabolic-Associated Fatty Liver Disease. Front Med (Lausanne). 2022 Jan 11;8:770504. doi: 10.3389/fmed.2021.770504. PMID: 35087844; PMCID: PMC8787199.
- Jaenisch R, Bird A. Epigenetic regulation of gene expression: how the genome integrates intrinsic and environmental signals. Nat Genet. (2003) 33:245–54. doi: 10.1038/ng1089
- Kouzarides T. Chromatin modifications and their function. (2007) 693:705. doi: 10.1016/j.cell.2007.02.005
- Angeloni A, Bogdanovic O. Enhancer DNA methylation: implications for gene regulation. Essays Biochem. (2019) 63:707–15. doi: 10.1042/EBC20190030
- Berger SL. The complex language of chromatin regulation during transcription. (2007) 407:12. doi: 10.1038/nature05915
- Jenuwein T, Allis CD. Translating the histone code. (2001) 1074:80. doi: 10.1126/science.1063127
- Landrier JF, Derghal A, Mounien L. MicroRNAs in obesity and related metabolic disorders. (2019) 8:859. doi: 10.3390/cells8080859