Por Elda Ariadna Flores Contreras
La detección del virus SARS-CoV-2 ha sido de vital importancia, debido a la gran cantidad de pérdidas humanas que ha ocasionado, reportándose en enero del 2022 más de 5 millones de muertes a nivel mundial, de acuerdo con la OMS (Organización Mundial de la Salud o WHO por sus siglas en inglés). Lo anterior ha provocado que investigadores de empresas privadas y de universidades desarrollen nuevos dispositivos que nos permitan detectar oportunamente este virus y evitar su diseminación.
Entre las tecnologías que han llamado la atención están los dispositivos microfluídicos denominados también laboratorios en un chip. La fabricación de estos dispositivos ha permitido que disciplinas tan diversas como la física, la química, Ingeniería y la Biotecnología interactúen para desarrollarlos.
Estas plataformas microfluídicas se utilizan en áreas tan variadas como es en: diagnóstico molecular para detectar enfermedades como cáncer y determinar la fase en la cual se encuentra el paciente, si es temprana o tardía; así como en la identificación de virus, bacterias u otros patógenos que pudiesen estar alterando la salud de los pacientes. Además, son excelentes simuladores de cómo los órganos se verían afectados tras el uso de drogas, contaminantes ambientales u otras sustancias de uso cotidiano que tienen un impacto en la salud de la población. También, en la parte ambiental han tenido un importante desempeño para identificar la presencia de contaminantes ambientales en agua, aire o suelo.
Con respecto a la identificación de SARS-CoV-2, los dispositivos microfluídicos utilizan fluidos en una sola dirección y gases que pasan por microcanales, permitiendo detectar material genético del virus, partículas virales o anticuerpos específicos contra SARS-CoV-2, de muestras tan complejas, debido a la gran cantidad de proteínas, enzimas entre otros elementos secretadas por el cuerpo como: saliva, nasofaríngeas, o de sangre; las cuales pueden introducirse directamente en el dispositivo microfluídico sin necesidad de procesar a diferencia de los métodos convencionales (PCR tiempo real o ELISA) que requieren largos períodos de tiempo (de 4 horas a dos días), en los cuales se utilizan procedimientos muy laboriosos para purificar y procesar las muestras.
Además, estos pequeños laboratorios en chip permiten detectar partículas virales en concentraciones tan bajas que pueden abarcar rangos desde 100 copias virales hasta nanogramos que equivale a 1 x10 –9 gramos; y obtener resultados en menos de hora; y tienen la capacidad de procesar múltiples muestras. Estos dispositivos también ayudan ha determinar si la vacunación ha sido eficiente, al detectar anticuerpos anti-SARS-CoV-2 en personas no infectadas por dicho virus. Otro aspecto importante es que mediante los ensayos microfluídicos se puede predecir si los anticuerpos desarrollados serán capaces de combatir nuevas variantes que surjan. La interacción del virus con la plataforma microfluídica se detecta mediante diferentes tipos de señales que pueden ser cambios de voltaje, fluorescencia o cambios de color; estas señales son analizadas por smartphones, mediante el uso de aplicaciones amigables (figura 1).
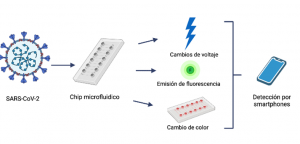
En conclusión, los laboratorios en chip son portables y no necesitan de laboratorios muy equipados o personal altamente calificado para su uso. Además, estos dispositivos son el claro ejemplo que el ingenio de los investigadores nunca cesa ante los retos de la naturaleza; y siempre están fabricando nuevas alternativas, para el diagnóstico preciso y temprano de cualquier tipo de enfermedad, en beneficio de la salud de la sociedad.
Sobre la autora
Elda Ariadna Flores Contreras. Es Doctora en Ciencias con Orientación en Biología Molecular e Ingeniería Genética, Profesora Catedrática de la Escuela de Ingeniería y Ciencias del Tecnológico de Monterrey, Campus Monterrey. [email protected]
Para más información:
- González-González, E., Garcia-Ramirez, R., Díaz-Armas, G. G., Esparza, M., Aguilar-Avelar, C., Flores-Contreras, E. A., Rodríguez-Sánchez, I. P., Delgado-Balderas, J. R., Soto-García, B., Aráiz-Hernández, D., Abarca-Blanco, M., Yee-De León, J. R., Velarde-Calvillo, L. P., Abarca-Blanco, A., & Yee-De León, J. F. (2021). Automated elisa on-chip for the detection of anti-sars-cov-2 antibodies. Sensors, 21(20), 1–12. https://doi.org/10.3390/s21206785.
- Pol, R., Céspedes, F., Gabriel, D., & Baeza, M. (2017). Microfluidic lab-on-a-chip platforms for environmental monitoring. TrAC Trends in Analytical Chemistry, 95, 62–68. https://doi.org/10.1016/J.TRAC.2017.08.001
- Schneider, M. M., Emmenegger, M., Xu, C. K., Condado Morales, I., Meisl, G., Turelli, P., Zografou, C., Zimmermann, M. R., Frey, B. M., Fiedler, S., Denninger, V., Jacquat, R. P., Madrigal, L., Ilsley, A., Kosmoliaptsis, V., Fiegler, H., Trono, D., Knowles, T. P., & Aguzzi, A. (2022). Microfluidic characterisation reveals broad range of SARS-CoV-2 antibody affinity in human plasma. Life Science Alliance, 5(2), e202101270. https://doi.org/10.26508/lsa.202101270
- World Health Organization (15 de enero 2022). Who Coronavirus (COVID-19) Dashboard. Recuperado de: https://covid19.who.int/table.


















