Por Edna Johana Bolívar Monsalve
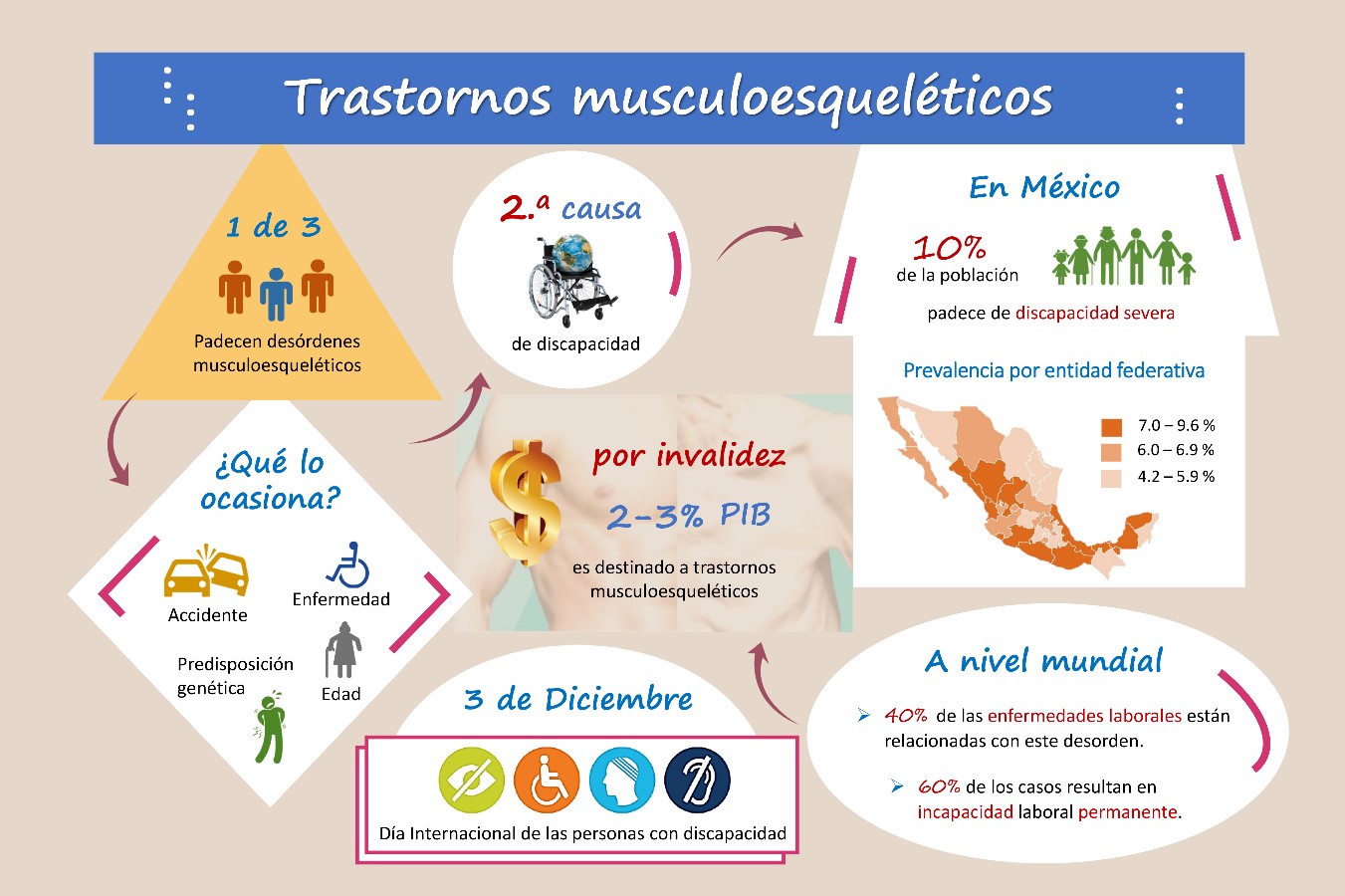
El músculo esquelético es un tejido con capacidad autoregenerativa, que brinda soporte y movimiento al cuerpo. Sin embargo, lesiones severas que ocasionen una pérdida mayor al 20% del volumen de este tejido, desencadenan inmovilidad física en la zona afectada. Este padecimiento es la segunda causa de discapacidad permanente a nivel mundial. Por lo tanto, la comunidad científica busca desarrollar tecnologías que permitan fabricar tejido muscular, con el propósito de regresar la movilidad a quienes padecen desórdenes musculoesqueléticos. No obstante, mimetizar la morfología y fisiología del músculo es un gran desafío.
 Retos asociados a la fabricación de músculo esquelético
Retos asociados a la fabricación de músculo esquelético
El músculo esquelético está compuesto por fibras altamente organizadas, que comprenden tamaños desde la nano hasta la macro escala. Este tipo de conformación ‘jerárquica’, está íntimamente relacionada con las funciones fisiológicas del tejido. Durante su proceso de maduración, las células musculares se unen y alinean formando fibras musculares. Al interior de estas fibras se encuentran filamentos de tamaño nanométrico conocidos como miofibrillas, las cuales permiten la contractilidad y elasticidad del músculo. Adicionalmente, este tejido está rodeado por nervios que envían señales eléctricas a las fibras musculares para promover su movimiento y vasos sanguíneos que abastecen el tejido de nutrientes y oxígeno.
Dentro de los retos asociados a la fabricación de músculo esquelético, destacan la necesidad de incorporar múltiples tipos celulares y ubicarlos en lugares estratégicos para asemejar al tejido natural. En especial, la incorporación de vasos sanguíneos se considera el talón de Aquiles del campo de la bioimpresión 3D. A la fecha no existe una técnica suficientemente efectiva para desarrollar vasculatura interconectada que mimetice la arquitectura y las funciones fisiológicas de los vasos sanguíneos naturales.
La bioimpresión 3D se ha popularizado por su versatilidad para generar estructuras tridimensionales definidas usando una biotinta compuesta de un hidrogel y células vivas. Sin embargo, los equipos disponibles comercialmente no tienen la capacidad para alcanzar dimensiones menores a 200 micrómetros (0.002mm), imposibilitando la ingeniería de tejidos complejos estructurados jerárquicamente. Además, el rendimiento de producción es deficiente, y el uso de múltiples materiales en una sola impresión es limitado.
Ante las dificultades descritas, el Grupo de Investigación con Enfoque Estratégico (GIEE) en Ingeniería Biomédica del Tecnológico de Monterrey, Centro de Biotecnología FEMSA, ha desarrollado un método denominado bioimpresión caótica. Esta estrategia reta las limitaciones relacionadas con el uso de múltiples líneas celulares, diversos materiales y generación de arquitecturas jerárquicas, aspectos primordiales en la biofabricación de músculo esquelético funcional.
La bioimpresión caótica y sus bondades en la fabricación de tejido músculo esquelético
La bioimpresión caótica es una técnica innovadora en el campo de la ingeniería de tejidos. Esta se basa en el uso de mezcladores estáticos acoplados en el interior de una punta o cabezal de impresión de dimensiones similares a un lápiz. Cuando dos o más fluidos son extruidos a través de estos mezcladores, se generarán flujos caóticos.
Para entender cómo opera un flujo caótico, se podría pensar en un proceso de deformación iterativa de un filamento de plastilina que se dobla a la mitad y seguidamente se estira. Esta receta de deformación se repetiría durante “n” número de ciclos. Tras este proceso, la longitud total del filamento de plastilina habrá incrementado exponencialmente. Por otro lado, si este filamento de plastilina se deforma solamente por acciones de estiramiento (sin plegamiento) durante el mismo número de ciclos, la longitud habrá incrementado linealmente (flujo regular).
La bioimpresión caótica genera filamentos con capas internas a la microescala, que exhiben un alto nivel de organización. El número de microcapas obtenidas es predecible matemáticamente y se asocia directamente al número de unidades que componen el mezclador caótico. Por ejemplo, al extruir dos biotintas a través de un cabezal de impresión conteniendo de 1 a 4 unidades de mezclado se obtienen de 2 a 16 microcapas dentro del filamento, respectivamente (Figura 2). Esto permite anticipar el ancho promedio de cada microcapa dentro del filamento bioimpreso, un aspecto relevante para la alineación de células y formación de fibras musculares. En este contexto, es importante entender que “caos” no significa desorden y tampoco se asocia con turbulencia.
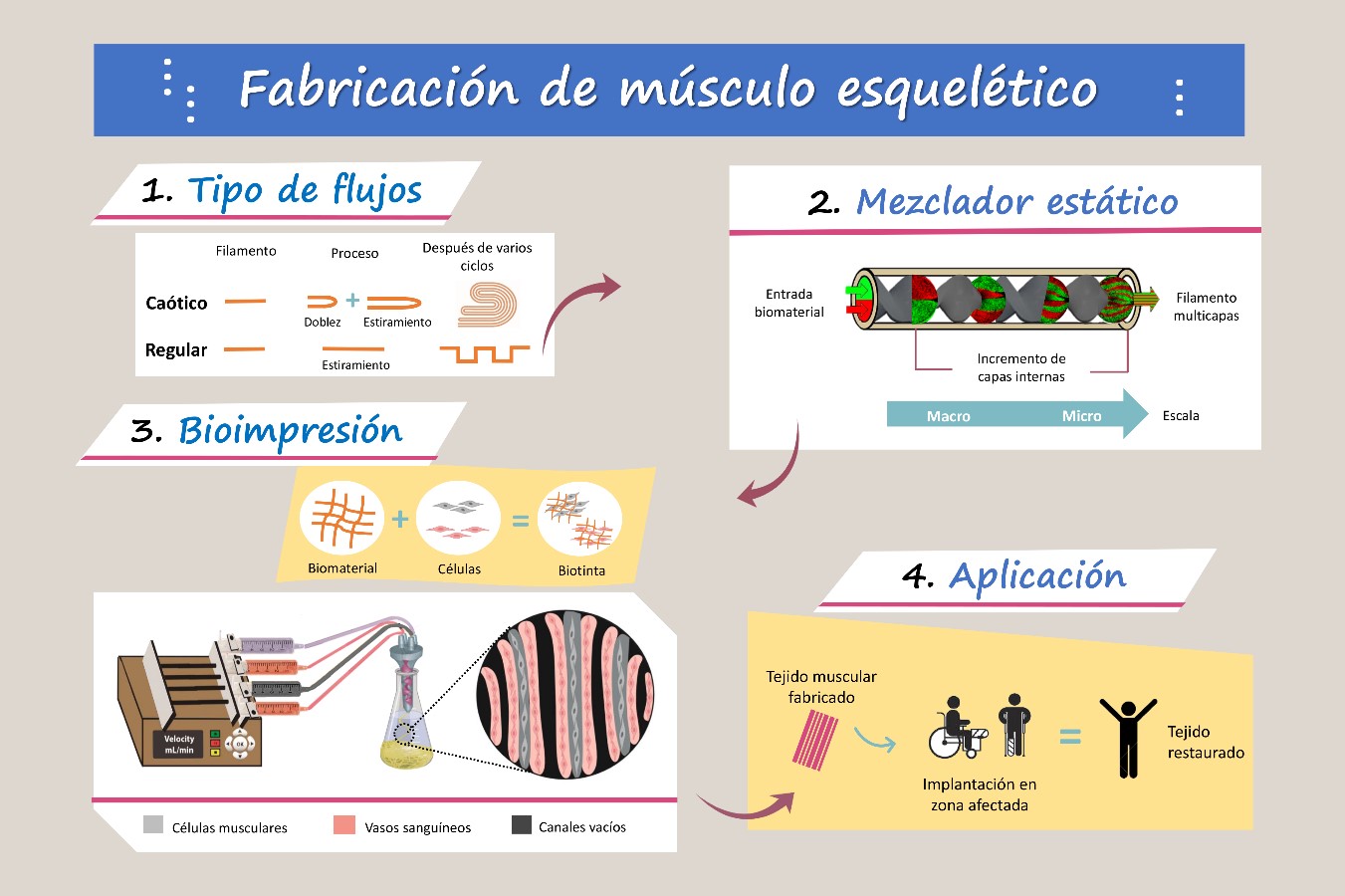
Para abordar la dificultad relacionada a la incorporación de vasos sanguíneos, se hace uso de una combinación de un material permanente y uno fugitivo (que abandona la estructura bioimpresa), dando como resultado filamentos con canales vacíos internos. Esto resulta relevante, ya que brinda la posibilidad de incorporar una versión simplificada de vasos sanguíneos en el tejido. Considerablemente, el diámetro de los canales producidos puede ser tan pequeño como el de un capilar sanguíneo, el cual se encuentra alrededor de 25 micrómetros (0.025mm), lo que representa un hito en el campo de la bioimpresión.
Con todo lo anterior, el Tecnológico de Monterrey demuestra su capacidad de innovación mediante la articulación de diferentes áreas del conocimiento, con el propósito de proveer a la sociedad herramientas que permitan enfrentar algunos de los desafíos de la salud pública global. En particular, se prevé que la bioimpresión caótica habilitará la producción de tejido muscular funcional que asemeje mucho más al tejido natural, mediante la inclusión de células endoteliales y células nerviosas para que en un futuro puedan ser utilizados en el tratamiento médico de enfermedades músculo-degenerativas.
Sobre la autora:
Edna Johana Bolívar Monsalve. Maestra en Ingeniería de Alimentos por la Universidad del Valle, Cali – Colombia. Estudiante de Doctorado en Biotecnología, Escuela de Ingeniería y Ciencias, Tecnológico de Monterrey, campus Monterrey. Contacto: [email protected], ORCID: https://orcid.org/0000-0003-3089-9419.
Asesores:
Dra. Grissel Trujillo de Santiago. Doctora en Biotecnología por el Tecnológico de Monterrey. Profesora. Centro de Biotecnología-FEMSA. Departamento de Ingeniería Mecatrónica y Eléctrica, Escuela de Ingeniería y Ciencias, Tecnológico de Monterrey. Investigadora del Sistema Nacional de Investigadores, Nivel I. http://alvareztrujillolab.com/. Contacto: [email protected]
Dr. Mario Moisés Álvarez. Doctor en Ingeniería Química y Bioquímica por la Universidad de Rutgers. Investigador del Sistema Nacional de Investigadores, Nivel III. Profesor Insignia Rómulo Garza. Centro de Biotecnología-FEMSA, Departamento de Bioingeniería, Escuela de Ingeniería y Ciencias, Tecnológico de Monterrey. http://alvareztrujillolab.com/. Contacto: [email protected]
Asesor Editorial:
Jesús Eduardo Elizondo Ochoa. Doctor en Biotecnología (Tecnológico de Monterrey), Doctor en Odontología, mención Doctor Internacional (UIC-Barcelona). Profesor-investigador del GIEE en Ingeniería Biomédica de la Escuela de Ingeniería y Ciencias y de la Escuela de Medicina y Ciencias de la Salud. Miembro del Sistema Nacional de Investigadores (CONACyT). Contacto: [email protected] ORCID: https://orcid.org/0000-0003-1763-9399
¿Te interesa saber más?
Edna Johana Bolívar-Monsalve, Carlos Fernando Ceballos-González, Karen Ixchel Borrayo-Montaño, Diego Alonso Quevedo-Moreno, Juan Felipe Yee-de León, Ali Khademhosseini, Paul S. Weiss, Mario Moisés Alvarez, Grissel Trujillo-de Santiago Grissel (2021). Continuous chaotic bioprinting of skeletal muscle-like constructs, Bioprinting, Volume 21.
https://www.sciencedirect.com/science/article/pii/S240588662030052X
Chávez-Madero, C., de Leon-Derby, M. D., Samandari, M., Ceballos-González, C. F., Bolívar-Monsalve, E. J., Mendoza-Buenrostro, C., … Trujillo-de Santiago Grissel. (2020). Using chaotic advection for facile high-throughput fabrication of ordered multilayer micro-and nanostructures: continuous chaotic printing. Biofabrication. 12(3), 035023 doi: https://doi.org/10.1088/1758-5090/ab84cc
https://onlinelibrary.wiley.com/doi/full/10.1002/adma.201906423
Artículo publicado
Bolívar-Monsalve, E. J., Ceballos-González, C. F., Borrayo-Montaño, K. I., Quevedo-Moreno, D. A., Yee-de León, J. F., Khademhosseini, A., Weiss, P.S., Alvarez, M. M, Trujillo-de Santiago, G. (2021). Continuous chaotic bioprinting of skeletal muscle-like constructs. Bioprinting, 21, e00125.
Congresos y foros virtuales
- Bolívar-Monsalve EJ, Ceballos-González CF, Quevedo-Moreno DA, Borrayo-Montaño KI, Lam-Aguilar LL, De la Cruz-Rivas B, Alvarez MM, Trujillo-de Santiago G. Continuous chaotic bioprinting. Oral presentation. BioNTERM Online Conference on March 29, 2021.
- Bolívar-Monsalve, E. J., Ceballos-González, C. F., Borrayo-Montaño, K. I., Quevedo-Moreno, D. A., Yee-de León, J. F., Khademhosseini, A., Weiss, P.S., Alvarez, M. M, Trujillo-de Santiago, G. Continuous chaotic bioprinting of skeletal muscle-like constructs. Pre-recorded talk. LatinXinBME Virtual Symposium on March 26, 2021.
- Ceballos-González CF, Bolívar-Monsalve EJ, Quevedo-Moreno DA, Lam-Aguilar LL, Borrayo-Montaño KI, Yee-de León JF, Zhang YS, Alvarez MM, Trujillo-de Santiago G. High-throughput and continuous chaotic bioprinting of spatially-controlled bacterial microcosms. Oral presentation. LatinXinBME Virtual Symposium on March 26, 2021.
- Ceballos-González CF, Bolívar-Monsalve EJ, Quevedo-Moreno DA, Lam-Aguilar LL, Borrayo-Montaño KI, Yee-de León JF, Zhang YS, Alvarez MM, Trujillo-de Santiago G. High-throughput and continuous chaotic bioprinting of spatially-controlled bacterial microcosms. Oral presentation. AIChE Virtual Annual Meeting on November 16-20, 2020.
- Ceballos-González CF, Bolívar-Monsalve EJ, Quevedo-Moreno DA, Lam-Aguilar LL, Borrayo-Montaño KI, Yee-de León JF, Zhang YS, Alvarez MM, Trujillo-de Santiago G. High-throughput and continuous chaotic bioprinting of spatially-controlled bacterial microcosms. Oral presentation. MIT Microbiome Symposium on April 15, 2021.
Agradecimientos
- Al programa ‘University of California Institute for Mexico and the United States (UC-MEXUS)’.
- A la fundación L’Oréal-UNESCO por las Mujeres en la Ciencia (L’Oréal-UNESCO For Women in Science).
- Al Consejo Nacional de Ciencia y Tecnología de México (CONACyT).

 Retos asociados a la fabricación de músculo esquelético
Retos asociados a la fabricación de músculo esquelético
















